美国时间11月24日,诺华宣布其新一代基因替代疗法Itvisma正式获得美国食品药品监督管理局(FDA)批准,用于治疗2岁及以上的脊髓性肌萎缩症(SMA)患者。这一消息迅速引发行业关注,被视为罕见病治疗领域的又一次关键突破。
一、新疗法覆盖更广人群
此次获批的Itvisma适用于携带SMN1基因突变的SMA患者,治疗年龄从两岁开始,首次覆盖更大年龄段患者,使此前难以获得基因替代治疗的群体迎来新的选择。
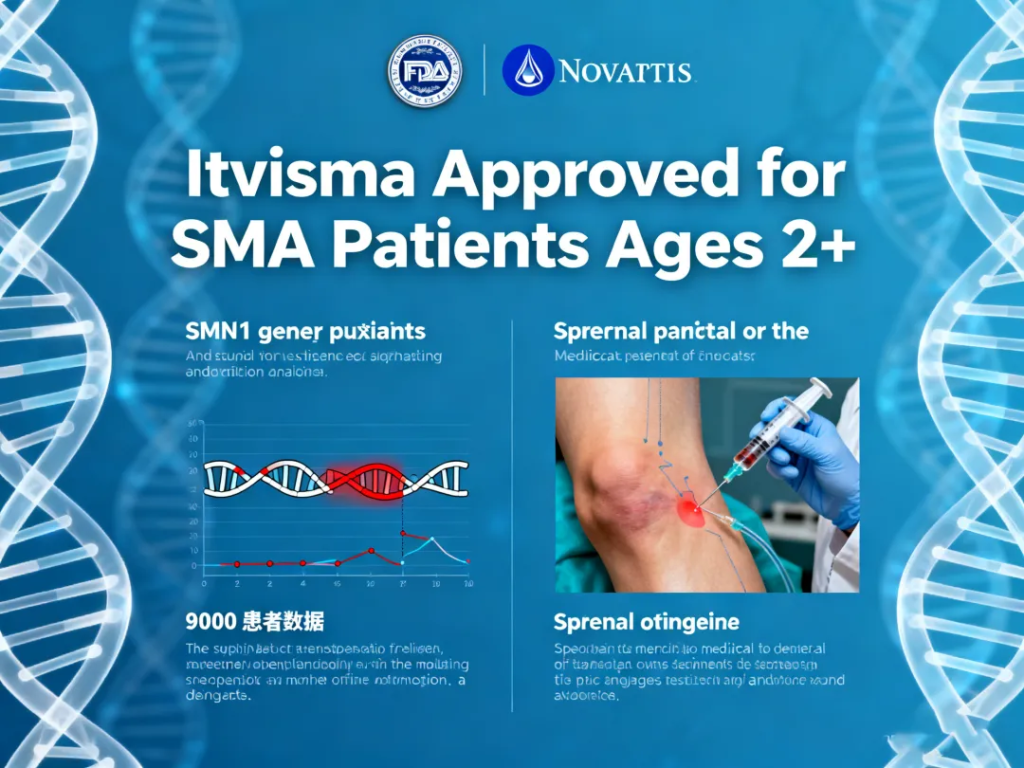
诺华此前已有基因疗法Zolgensma在全球上市,但其适应症仅限两岁以下患者。Itvisma的推出意味着整个治疗体系进一步完善,更有利于不同年龄、不同病程阶段的患者获得更适合的治疗方案。
二、与Zolgensma共享活性成分,但给药方式升级
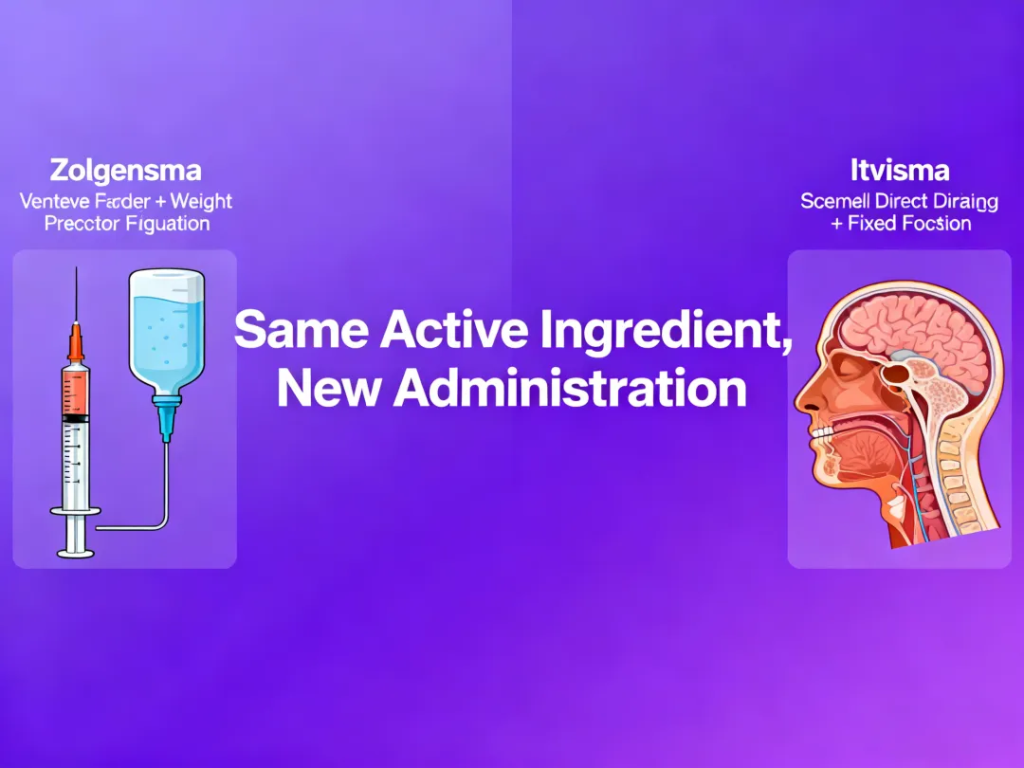
虽然Itvisma与Zolgensma采用相同的有效成分,但在剂型和给药方式上出现显著变化。
Zolgensma: 静脉输注,根据体重调整剂量
Itvisma: 脊髓腔内注射,不受体重影响,更精准地进入中枢神经系统
这种更集中的给药方式,有望提高药物利用效率,同时减少剂量计算的临床复杂性。
三、临床试验显示疗效明确
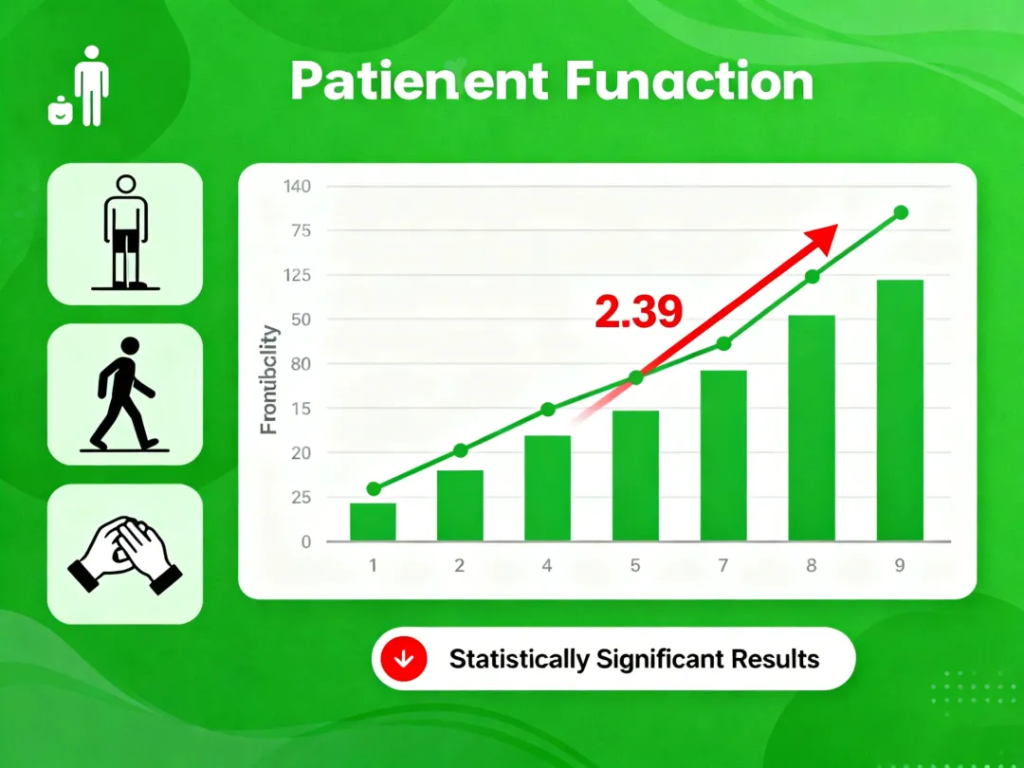
在一项晚期临床试验中,Itvisma的表现令人瞩目:
患者在运动能力评估量表上平均提升2.39分
疾病进展速率明显放缓
部分患者在姿势控制、基础动作等方面出现可感知改善
研究者表示,这一疗效提升具有明确的临床意义,为患者的日常生活质量带来实际帮助。
四、定价高于Zolgensma,但提供更广治疗覆盖
诺华公布的Itvisma批发收购价为259万美元,高于Zolgensma的210万美元。尽管价格高昂,但基因替代疗法多为“一次性给药、长期获益”的治疗模式,可减少长期治疗带来的经济负担。
企业负责人表示:“新疗法不仅扩大了可治疗人群,也为患者提供了更多选择,对任何罕见病家庭而言都是意义重大的。”
SMA:罕见病领域的关键挑战

五、如何预防春季传染疾病
脊髓性肌萎缩症是一种由SMN1基因缺失引发的神经肌肉疾病,影响患者呼吸、吞咽和基本运动能力,是婴儿遗传性死亡的主要原因之一。美国目前约有9000名患者长期受到该疾病影响。

基因替代疗法的出现,为改善疾病自然进程、提高生存率提供了真正的可能性。
六、小结
随着Itvisma的正式获批,SMA治疗迎来了新的拓展方向。从更精准的给药方式到更广泛的适用人群,这一疗法的到来不仅是技术进步的体现,也为患者带来了更现实的希望。
未来,随着更多临床数据的积累和真实世界证据的产生,SMA的治疗格局或将迎来进一步改变。
Eltromin 25mg/50mg Eltrombopag 艾曲波帕
Enatinib 4mg/10mg Lenvatinib 乐伐替尼
Lynparib 150mg Olaparib 奥拉帕利
Coltinib 15mg Upadacitini 乌帕达替尼
Alvonib 80mg Osimertinib 奥希替尼
法玛希Pharmacil 科诺Techno
孟加拉制药官网:www.radiantpharmacil.com
瑞德安 Radiant










暂无评论内容