近日,Telix公司宣布,其前列腺癌核心候选药物TLX591(鲁锶177标记的rosopatamab tetraxetan)在ProstACT Global 3期临床试验第二部分(随机治疗扩展)中,首例患者已在澳大利亚墨尔本前列腺中心(APC)完成给药。该试验针对**转移性去势抵抗性前列腺癌(mCRPC)**患者进行评估,标志着Telix在晚期前列腺癌治疗管线中取得重要里程碑。
ProstACT Global试验亮点
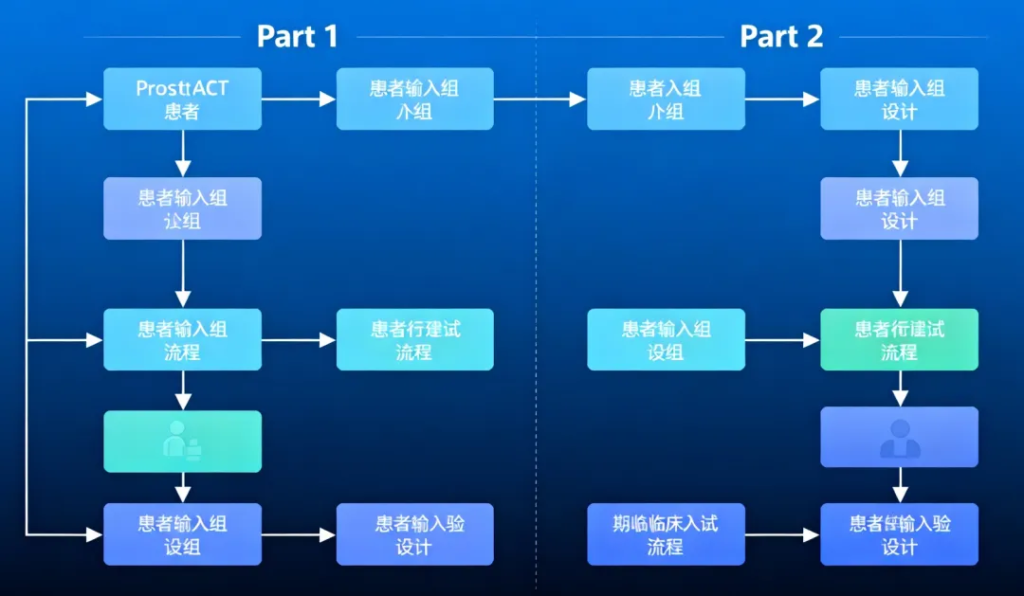
ProstACT Global是首个将**PSMA靶向放射性抗体偶联药物(rADC)与标准治疗(SOC)**联合,进行随机对照的国际多中心3期试验。试验分为两部分:
- Part 1:安全性和剂量引入,已完成30例患者入组。
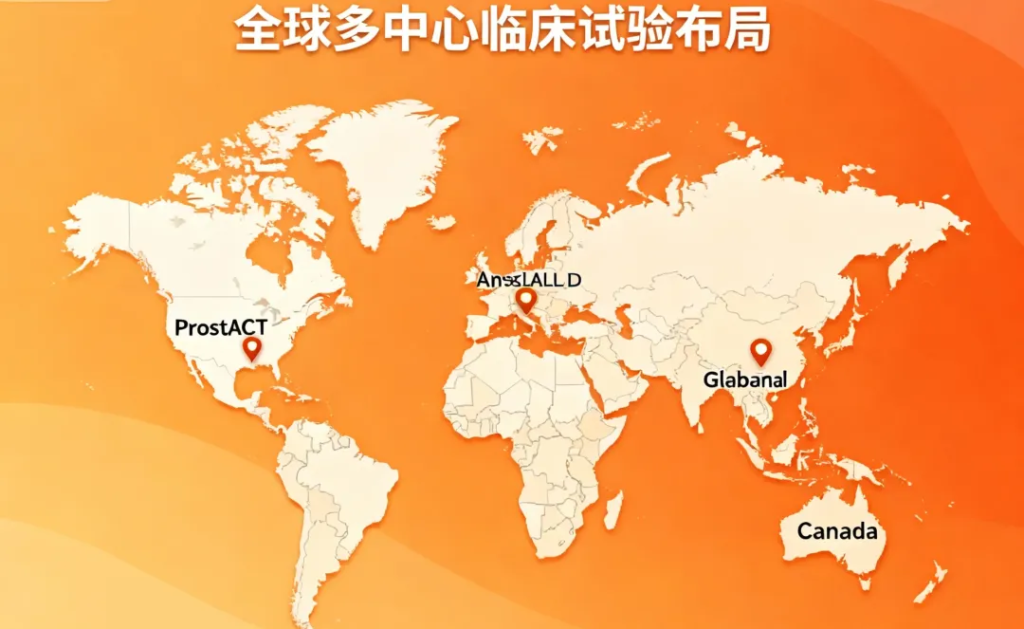
- Part 2:2:1随机全球扩展,计划入组约490名患者,目前在澳大利亚、新西兰和加拿大招募中。
此次首例患者入组Part 2,为全球随机治疗扩展阶段奠定了基础,同时Telix计划在美国、欧洲、中国、日本、新加坡、韩国、土耳其和英国进一步启动试验扩展。Part 1初步数据将向美国FDA和欧洲EMA提交,用于推动Part 2在更多地区开展。
TLX591的创新优势
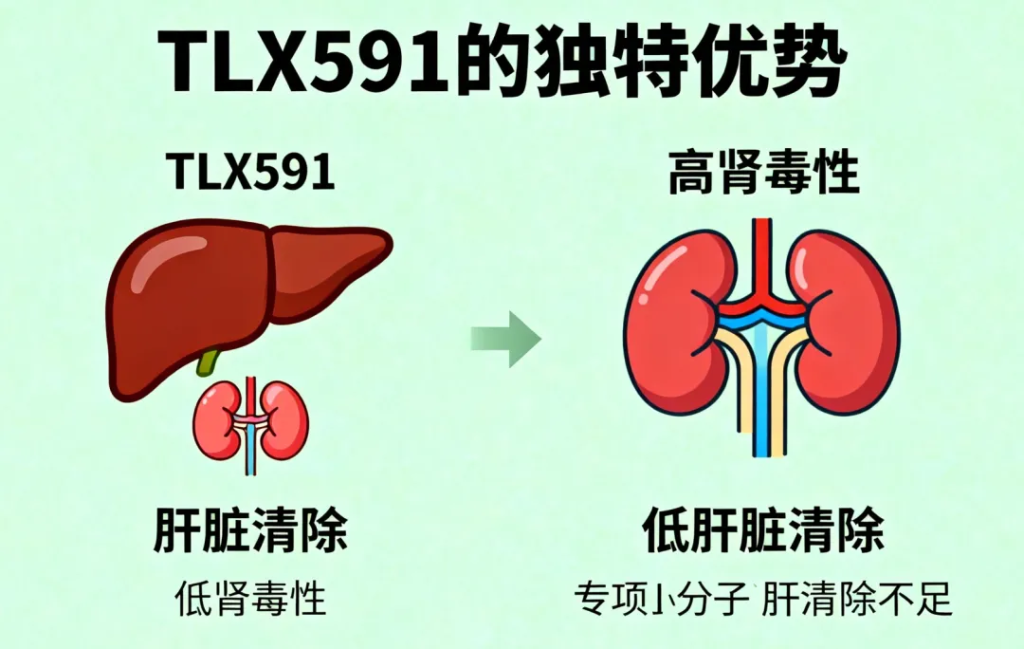
TLX591与现有PSMA靶向小分子放射性配体疗法(RLT)相比,具有独特的靶向和药代学特点:
- 肝脏清除、肾毒性低:长期随访显示,TLX591未观察到显著的急性或延迟肾毒性风险。
- 唾液腺和泪腺吸收少:大分子特性减少了干口干眼的不良反应,这也是现有PSMA靶向RLT常见的副作用。
- 联合标准治疗:与阿比特龙、恩杂鲁胺或多西他赛联合使用,为mCRPC患者提供更多治疗选择。
临床前景与意义
Dr. David N. Cade(Telix首席医学官)表示:“首例患者入组Part 2随机治疗扩展,是Telix晚期前列腺癌药物管线的重要里程碑。我们期待在未来数月内向FDA和EMA提交Part 1初步数据。”
此次3期试验不仅是药物疗效验证的重要步骤,也为全球mCRPC患者提供新的治疗希望。随着全球试验的推进,TLX591有望在安全性、疗效和耐受性方面提供更佳的治疗体验。
结语
ProstACT Global 3期临床的顺利推进,标志着PSMA靶向rADC疗法在mCRPC治疗领域进入关键发展阶段。随着全球多中心试验扩展及Part 1初步数据披露,TLX591或将成为晚期前列腺癌治疗的重要新选择,值得临床和患者持续关注。
参考信息:
- ProstACT Global(NCT06520345)详细信息请见Telix官网
- TLX591尚未在任何地区获得上市授权
Eltromin 25mg/50mg Eltrombopag 艾曲波帕
Enatinib 4mg/10mg Lenvatinib 乐伐替尼
Lynparib 150mg Olaparib 奥拉帕利
Coltinib 15mg Upadacitini 乌帕达替尼
Alvonib 80mg Osimertinib 奥希替尼
法玛希Pharmacil 科诺Techno










暂无评论内容